Что можно приготовить из кальмаров: быстро и вкусно
Инструкция
Прежде чем приступать к самому заданию, нужно усвоить, что цифра, которая ставится перед химическим элементом или всей формулой называется коэффициентом. А цифра, стоящая после (и чуть внизу) означает индекс. Кроме этого нужно знать , что:
В другом расколе химических реакций учитываются реакции, которые не меняют степень окисления реагентов, и те, в которых степень окисления реагентов изменяется после реакции. В химических реакциях, при которых не происходит переноса электрона, стехиометрические коэффициенты выбираются только на основе закона сохранения массы. Кроме того, в случае ионных реакций важно помнить, что сумма отрицательных и положительных зарядов с обеих сторон химического уравнения одинакова. Реакции, которые происходят без изменения степени окисления, зависят прежде всего от обмена протонов между реагирующими молекулами.
Коэффициент относится ко всем химическим символам, стоящим после него в формуле
Коэффициент умножается на индекс (не складывается!)
число атомов каждого элемента вступающих в реакцию веществ должно совпадать с числом атомов этих элементов, входящих в состав продуктов реакции.
Такие реакции включают, например, реакции нейтрализации; кислотных, солевых и щелочных реакций с солями и водными реакциями с ионами. Если происходит обмен электронами между реакционноспособными веществами, наблюдаются реакции окислительно-восстановительного процесса, иначе называемые окислительно-восстановительными реакциями.
Окисление представляет собой процесс донорства электронов атомами или группами атомов, а восстановление - процесс, который включает в себя прием электронов. Веществом, которое теряет электроны, является редуктор, а вещество, которое рисует электроны, является окислителем. Окисление всегда сопровождается восстановлением, и наоборот, восстановление всегда сопровождается окислением.
Например, запись формулы 2H2SO4 означает 4 атома H (водорода), 2 атома S (серы) и 8 атомов O (кислорода).
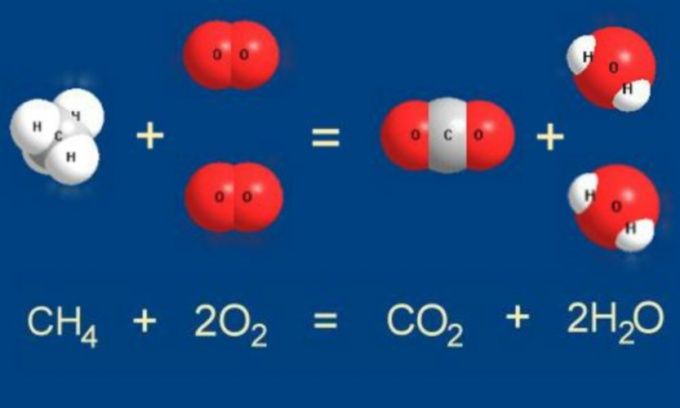
1. Пример № 1. Рассмотрим уравнение горения этилена.
При сгорании органического вещества образуются оксид углерода (IV) (углекислый газ) и вода. Попробуем последовательно расставить коэффициенты.
С другой стороны, сильные окислительные свойства: хлор, бром, кислород, перманганат калия и перекись водорода. Стехиометрические соотношения в реакциях окислительно-восстановительной реакции выбираются на основе знания степеней окисления. Степень окисления элемента, который является частью вещества, является условным, и мы обозначаем число отрицательных или положительных элементарных зарядов, которые были бы отнесены к атомам этого элемента, если бы молекулы такого вещества имели ионную структуру.
К определению степени окисления применяются следующие правила. Следует соблюдать осторожность при применении концепции окисления в комбинациях, содержащих множественные связи и с более чем одним атомом одного и того же элемента. Редокс-реакция - это процесс обмена электронами между двумя веществами. Это четко связано с изменениями окислительных состояний элементов этих веществ. Реакции окислительно-восстановительных реакций иначе называются реакциями окисления и восстановления, так как окислительно-восстановительные реакции происходят одновременно при окислении и восстановлении.
C2H4 + O2 => CO2+ H2O
Начинаем анализировать. В реакцию в ступило 2 атома С (углерода), а получился только 1 атом, значит перед CO2 ставим 2. Теперь их количество одинаково.
C2H4 + O2 => 2CO2+ H2O
Теперь смотрим на H (водород). В реакцию вступило 4 атома водорода, а получилось в результате только 2 атома, следовательно, перед H2O (водой) ставим 2 – теперь получилось тоже 4
Окисление - это процесс, посредством которого электроны жертвуют электроны, поэтому этот процесс иначе называют болезнетворным. Это всегда связано с увеличением окисления атома данного элемента. Редукция - это процесс, посредством которого электроны получают электроны, поэтому этот процесс иначе называют электронами. Это всегда связано с уменьшением окисления атома данного элемента.
В соответствии с приведенными выше определениями реакций окисления и восстановления можно сформулировать, какие окислители и восстановители. Окислитель представляет собой атом или ион, который редоксен при окислительно-восстановительной реакции и, следовательно, обладает свойствами подбора электронов из других атомов, окисления их и их принятия.
C2H4 + O2 => 2CO2+ 2H2O
Считаем все атомы О (кислорода), образовавшиеся в результате реакции (то есть, после знака равенства). 4 атома в 2CO2 и 2 атома в 2H2O – всего 6 атомов. А до реакции всего 2 атома, значит, перед молекулой кислорода O2 ставим 3, а значит, их стало тоже 6.
C2H4 + 3O2 => 2CO2+ 2H2O
Таким образом, получилось одинаковое количество атомов каждого элемента до и после знака равенства.
Редуктор представляет собой атом или ион, который реагирует с окислением во время реакции и поэтому обладает свойством донорства электронов другим атомам, тем самым уменьшая его. Окислители включают вещества, которые могут понижать свое окисление. К ним относятся наиболее электроотрицательные элементы, такие как фтор, кислород и хлор - они легко принимают электроны для валентного покрытия с образованием электронов электронов, которые действуют как электроны. Прочитайте словарь иностранных слов; Химические соединения, содержащие элементы, атомы которых могут понижать свое окисление.
C2H4 + 3O2 => 2CO2+ 2H2O
2. Пример № 2. Рассмотрим реакцию взаимодействия алюминия с разбавленной серной кислотой.
Al + H2SO4 => Al2 (SO4) 3 + H2
Смотрим на атомы S, входящие в состав Al2 (SO4) 3 - их 3, а в H2SO4 (серной кислоте) только 1, следовательно, и перед серной кислотой тоже ставим 3.
Al + 3H2SO4 => Al2 (SO4) 3 + H2
Зато теперь получилось до реакции 6 атомов H (водорода), а после реакции только 2, значит, перед молекулой H2 (водорода) ставим тоже 3, чтобы в целом получилось 6.
Самые сильные окислители включают те химические вещества, в которых элементы присутствуют при максимальных состояниях окисления. Примеры: перекись водорода, перманганат калия, азотная кислота. Азотная кислота. - сильная кислота, агрессивная жидкость, используемая при производстве удобрений, красителей, взрывчатых веществ и фармацевтических препаратов. Прочтите словарь иностранных слов, дихромат калия.
Редукторы включают вещества, которые могут увеличить свое окисление. Среди них можно выделить: большинство электролитических элементов, таких как водород, углерод, натрий или калий, легко дают электроны из валентного покрытия; Химические соединения, содержащие элементы, атомы которых могут увеличить свое окисление. Самыми мощными редукторами являются те соединения, в которых элементы встречаются при минимальных состояниях окисления. Примеры: нитрат калия, оксид серы, хлорид олова.
Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
В последнюю очередь смотрим на алюминий . Так как в Al2 (SO4) 3 (сульфате алюминия) всего 2 атома алюминия, то и до реакции перед Al (алюминием) ставим 2.
2Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
Теперь количество всех атомов до и после реакции совпадает. Оказалось, что расставлять коэффициенты в химических уравнениях не так и сложно. Достаточно потренироваться и все получится.
Реакция сжигания магния в кислороде. В этом уравнении магний является редуктором, а кислород - окислителем. Б) реакция синтеза хлористого водорода от элементов. В этом уравнении водород является восстановителем, а хлор является окислителем. Степень окисления представляет собой концепцию чисто практического значения, чрезвычайно полезную при согласовании окислительно-восстановительных реакций. Степень окисления называется числом элементарных зарядов, которые появлялись бы на данном атоме элемента, предполагая, что все связи в данной химической молекуле будут чисто ионными.
Для многих школьников написать уравнения химических реакций и правильно расставить коэффициенты нелегкая задача. Причем, главную трудность у них почему-то вызывает именно вторая ее часть. Казалось бы, ничего сложного в том нет, однако порой ученики пасуют, впадая в полную растерянность. А ведь надо всего лишь запомнить несколько простых правил, и задача перестанет вызывать затруднения.
В природе нет соединений полностью ионной конструкции, поэтому степень окисления никогда не является реальным зарядом, только гипотетическая. При определении степени окисления элементов применяются следующие правила. В электрически инертной молекуле сумма степеней окисления всех атомов, которые строят данную молекулу, всегда равна нулю. В катионах и в анионах сумма степеней окисления всех атомов, которые строят данный ион, всегда равна сумме окисления. Бериллий Бериллий хм. - химические элементы, образующие вторую группу периодической таблицы: берил, магний, кальций, стронций, барий, радий; Химически активные металлы, встречающиеся в природе в соединениях. Свободное состояние всегда имеет нулевое состояние окисления. . Следует проявлять осторожность при назначении степеней окисления в соединениях, в которых присутствуют два или более атомов, так как каждый из них может находиться в другом состоянии окисления.
ы в уравнениях химических реакций, если данная тема в школьном курсе по ряду каких-либо причин прошла мимо, а знать, между тем, это необходимо. Правильно расставлять коэффициенты можно, соблюдая определенные правила. Данный способ называется метод подстановки.
Инструкция
Прежде чем приступать к самому заданию, нужно усвоить, что цифра, которая ставится перед химическим элементом или всей формулой называется коэффициентом. А цифра, стоящая после (и чуть внизу) означает индекс. Кроме этого нужно знать, что:
Точно так же понятие окисления не может быть применено к соединениям медь-металл. Электронный баланс редокс-реакции. Концепции реакций окисления и окисления и восстановления имеют практическое применение для согласования химических уравнений. Чтобы согласовать коэффициенты химических реакций, стоит использовать так называемый. половина уравнений. Одно уравнение реакции распадается на два, один из которых описывает ход реакции окисления, а другой - уменьшение.
Балансировка уравнений выполняется следующим образом. На основе выбранных множителей дополняют уравнение реакции окислительно-восстановительного процесса в недостающих коэффициентах. Из вышесказанного видно, что степень окисления меди и азота изменилась в результате реакции.
Коэффициент относится ко всем химическим символам, стоящим после него в формуле
Коэффициент умножается на индекс (не складывается!)
Число атомов каждого элемента вступающих в реакцию веществ должно совпадать с числом атомов этих элементов, входящих в состав продуктов реакции.
Например, запись формулы 2H2SO4 означает 4 атома H (водорода), 2 атома S (серы) и 8 атомов O (кислорода).
Мы умножаем множители для этих реакций: они соответственно являются номерами 3 и 2, которые мы можем написать. Вы не можете сразу ввести номер 2 перед азотной кислотой, потому что не все атомы азота, полученные из этой кислоты, были уменьшены. Дальнейшие простые дополнения приводятся к следующим факторам.
Из вышесказанного видно, что степень окисления серы и хлора изменилась в результате реакции. Мы можем написать полууравнения. Коэффициенты, полученные из суммы двух полууровней, затем могут быть записаны в исходное уравнение реакции. Среди окислительно-восстановительных реакций можно выделить два конкретных случая его возникновения.
1. Пример № 1. Рассмотрим горения этилена.
При сгорании органического вещества образуются оксид углерода (IV) (углекислый газ) и вода. Попробуем последовательно расставить коэффициенты.
C2H4 + O2 => CO2+ H2O
Начинаем анализировать. В реакцию в ступило 2 атома С (углерода), а получился только 1 атом, значит перед CO2 ставим 2. Теперь их количество одинаково.
Первая - окислительно-восстановительная реакция, во время которой происходит окисление и одновременное восстановление одного и того же элемента при определенной степени окисления. Он играет роль как редуктора, так и окислителя. Эта реакция называется реакцией дисмутации.
Другая - окислительно-восстановительная реакция, когда два атома одного и того же элемента, присутствующих в разных состояниях окисления, окисляют и уменьшают реакцию, которая содержит соединение в состоянии окисления. Эту реакцию называют реакцией синтеза.
Из вышесказанного видно, что реакция изменила степень окисления хлора и только хлора! Мы умножаем множители для этих реакций: они соответственно 3 и 1, которые мы можем написать. Таким образом, мы уже получили согласованное уравнение химической реакции.
C2H4 + O2 => 2CO2+ H2O
Теперь смотрим на H (водород). В реакцию вступило 4 атома водорода, а получилось в результате только 2 атома, следовательно, перед H2O (водой) ставим 2 – теперь получилось тоже 4
Окисление - это процесс, посредством которого электроны жертвуют электроны, поэтому этот процесс иначе называют болезнетворным. Это всегда связано с увеличением окисления атома данного элемента. Редукция - это процесс, посредством которого электроны получают электроны, поэтому этот процесс иначе называют электронами. Это всегда связано с уменьшением окисления атома данного элемента.
В соответствии с приведенными выше определениями реакций окисления и восстановления можно сформулировать, какие окислители и восстановители. Окислитель представляет собой атом или ион, который редоксен при окислительно-восстановительной реакции и, следовательно, обладает свойствами подбора электронов из других атомов, окисления их и их принятия.
C2H4 + O2 => 2CO2+ 2H2O
Считаем все атомы О (кислорода), образовавшиеся в результате реакции (то есть, после знака равенства). 4 атома в 2CO2 и 2 атома в 2H2O – всего 6 атомов. А до реакции всего 2 атома, значит, перед молекулой кислорода O2 ставим 3, а значит, их стало тоже 6.
C2H4 + 3O2 => 2CO2+ 2H2O
Таким образом, получилось одинаковое количество атомов каждого элемента до и после знака равенства.
C2H4 + 3O2 => 2CO2+ 2H2O
2. Пример № 2. Рассмотрим реакцию взаимодействия алюминия с разбавленной серной кислотой.
Al + H2SO4 => Al2 (SO4) 3 + H2
Смотрим на атомы S, входящие в состав Al2 (SO4) 3 - их 3, а в H2SO4 (серной кислоте) только 1, следовательно, и перед серной кислотой тоже ставим 3.
Субстраты и продукты, обычно реагенты, могут быть атомами, молекулами, ионами или радикалами. Если все реагенты присутствуют в одной и той же фазе, химическая реакция называется, если она находится в разных фазах. Однородные реакции протекают одновременно во всей гетерогенной фазе - главным образом на границе раздела. Количественные соотношения между реагентами даются с помощью стехиометрического уравнения. Химические реакции обычно состоят из нескольких последовательных этапов.
Фактический ход химической реакции называется реакционным механизмом. Некоторые реакции происходят очень быстро, такие как разложение взрывчатого вещества, фотохимические реакции в газах, другие - очень медленные процессы, например химические изменения, происходящие в земной коре в течение тысяч лет. Эта зависимость может быть объяснена на основе кинетической теории материи. Чтобы молекулы реагировали, они должны «встречаться». В газовой фазе они очень распространены, с очень коротким временем столкновения молекул, которые теория рассматривает как сферы.
Al + 3H2SO4 => Al2 (SO4) 3 + H2
Зато теперь получилось до реакции 6 атомов H (водорода), а после реакции только 2, значит, перед молекулой H2 (водорода) ставим тоже 3, чтобы в целом получилось 6.
Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
В последнюю очередь смотрим на алюминий. Так как в Al2 (SO4) 3 (сульфате алюминия) всего 2 атома алюминия, то и до реакции перед Al (алюминием) ставим 2.
2Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
Теперь количество всех атомов до и после реакции совпадает. Оказалось, что расставлять коэффициенты в химических уравнениях не так и сложно. Достаточно потренироваться и все получится.
Для многих школьников написать уравнения химических реакций и правильно расставить коэффициенты нелегкая задача. Причем, главную трудность у них почему-то вызывает именно вторая ее часть. Казалось бы, ничего сложного в том нет, однако порой ученики пасуют, впадая в полную растерянность. А ведь надо всего лишь запомнить несколько простых правил, и задача перестанет вызывать затруднения.
В природе нет соединений полностью ионной конструкции, поэтому степень окисления никогда не является реальным зарядом, только гипотетическая. При определении степени окисления элементов применяются следующие правила. В электрически инертной молекуле сумма степеней окисления всех атомов, которые строят данную молекулу, всегда равна нулю. В катионах и в анионах сумма степеней окисления всех атомов, которые строят данный ион, всегда равна сумме окисления. Бериллий Бериллий хм. - химические элементы, образующие вторую группу периодической таблицы: берил, магний, кальций, стронций, барий, радий; Химически активные металлы, встречающиеся в природе в соединениях. Свободное состояние всегда имеет нулевое состояние окисления. . Следует проявлять осторожность при назначении степеней окисления в соединениях, в которых присутствуют два или более атомов, так как каждый из них может находиться в другом состоянии окисления.
Инструкция
Коэффициент, то есть число, стоящее перед формулой молекулы химического вещества, относится ко всем символам, и умножается на каждый индекс каждого символа! Именно умножается, а не складывается! Это может показаться невероятным, но некоторые школьники складывают два числа вместо того, чтобы их перемножить.
Иными словами, если в левой части реакции записано:
2Na3PO4 + 3CaCl2 = … Это значит, что в реакцию вступило 6 атомов натрия, 2 атома фосфора, 8 атомов кислорода, 3 атома кальция и 6 атомов хлора.
Количество атомов каждого элемента исходных веществ (то есть находящихся в левой части уравнения) должно совпадать с количеством атомов каждого элемента продуктов реакции (соответственно, находящихся в его правой части).
Рассмотрим это правило, записав до конца уравнение реакции фосфата натрия с хлористым кальцием. Для большей наглядности, уберите из левой части уравнения коэффициенты . Na3PO4 + CaCl2 = Ca3(PO4)2 + NaCl
В ходе реакции образуется практически нерастворимая соль – фосфат кальция – и хлористый натрий. Как же расставить коэффициенты ? Сразу обратите внимание, что у фосфат-иона (РО4) в правой части уравнения индекс равен двум. Поэтому, чтобы уравнять количества атомов фосфора и кислорода в левой и правой части, перед формулой молекулы фосфата натрия надо поставить коэффициент 2. Получится: 2Na3PO4 + СaCl2 = Ca3(PO4)2 + NaCl
Вы видите, что количество атомов фосфора и кислорода уравнено, но пока еще различно количество атомов натрия, кальция и хлора. В левой части: натрия – 6 атомов, кальция – 1 атом, хлора – 2 атома. В правой части, соответственно: натрия – 1 атом, кальция – 3 атома, хлора – 1 атом.
Уравнивайте количество атомов натрия, приписав коэффициент 6 к молекуле хлористого натрия. Получается: 2Na3(PO4)2 + CaCl2 = Ca3(PO4)2 + 6NaCl
Осталось уравнять последние два элемента. Вы видите, что в левой части 1 атом кальция и 2 атома хлора, а в правой - 3 атома кальция и 6 атомов хлора. То есть, ровно в три раза больше! Подставляя коэффициент 3 к молекуле хлористого кальция, получите итоговое уравнение: 2Na3(PO4)2 + 3CaCl2 = Ca3(PO4)2 + 6NaCl