Что можно приготовить из кальмаров: быстро и вкусно
РАССТАНОВКА КОЭФФИЦИЭНТОВ
Число атомов одного элемента в левой части уравнения должно быть равно числу атомов этого элемента в правой части уравнения.
Задание 1 (для групп). Определите число атомов каждого химического элемента, участвующего в реакции.
1. Вычислите число атомов:
а) водорода: 8NH3, NaOH, 6NaOH, 2NaOH, НзРО4, 2H2SO4, 3H2S04, 8H2SO4;
Определите реактивы и продукты в реакции
Реактивы: сахар и кислород. Продукты: двуокись углерода и вода.
Подсчитайте количество атомов каждого элемента в реагентах и в продуктах
Легче начать с углерода, поскольку он появляется только один раз с каждой стороны. Снова измените коэффициенты, чтобы попытаться сбалансировать уравнение. Попробуем на этот раз увеличить количество водородов.Теперь нам просто нужно сбалансировать атомы кислорода
Упражнение 1: Балансирование простых химических уравнений
Сбалансируйте следующие уравнения. Начнем с подсчета количества каждого атома в реагентах и продуктах. Теперь мы проверяем количество атомов в реагентах и продуктах. Оксигены сбалансированы, а магния - нет.6) кислорода : C02, 3C02, 2C02, 6CO, H2SO4, 5H2SO4, 4H2S04, HN03.
2. Вычислите число атомов: а) водорода:
1) NaOH + HCl 2)CH4+H20 3)2Na+H2
б) кислорода:
1) 2СО + 02 2) С02 + 2Н.О. 3)4NO2 + 2H2O + O2
Алгоритм расстановки коэффициентов в уравнениях химических реакций
А1 + О2→ А12О3А1-1 атом А1-2
О-2 атома О-3
Если подсчитать количество атомов каждого элемента в реагентах и продуктах, мы найдем. Хлорид бария реагирует с серной кислотой для получения сульфата бария и соляной кислоты. Этан реагирует с кислородом с образованием двуокиси углерода и пара. Сначала напишем уравнение для реакции.
Карбонат аммония часто используется в качестве пахнущей соли. Водородные топливные элементы чрезвычайно важны для развития альтернативных источников энергии. Многие из этих клеток работают путем взаимодействия водорода и кислородных газов вместе с образованием воды, что также приводит к электричеству.
2. Среди элементов с разным числом атомов в левой и правой частях схемы выбрать тот, число атомов которого больше
О-2 атома слева
О-3 атома справа
3. Найти наименьшее общее кратное (НОК) числа атомов этого элемента в левой части уравнения и числа атомов этого элемента в правой части уравнения
НОК = 6
4. Разделить НОК на число атомов этого элемента в левой части уравнения, получить коэффициент для левой части уравнения
Государственные символы и другая информация
Синтез аммиака, сделанный известным немецким химиком Фрицем Хабером в начале 20-го века, является одной из самых важных реакций в химической промышленности. Состояние соединений может быть выражено в химическом уравнении. Это делается путем размещения правильной метки в правой части формулы. Можно использовать следующие четыре метки.
Пример 4: Балансирование химических уравнений 4
Для газообразных соединений для жидкостей для твердых соединений для водного раствора. Чтобы показать, что для реакции требуется тепло, греческая дельта находится над стрелкой. Твердый цинковый металл реагирует с водной соляной кислотой с образованием водного раствора хлорида цинка и газообразного водорода.
6:2 = 3
Аl + ЗО 2 →Аl 2 О 3
5. Разделить НОК на число атомов этого элемента в правой части уравнения, получить коэффициент для правой части уравнения
6:3 = 2
А1+ О 2 →2А1 2 О3
6. Если выставленный коэффициент изменил число атомов еще какого-либо элемента, то действия 3, 4, 5 повторить еще раз.
Определение реагентов и продуктов
Реагенты представляют собой цинк и соляную кислоту. Продукты представляют собой хлорид цинка и водород. Вы заметите, что атомы цинка балансируют, а атомы хлора и водорода - нет.
Убедитесь, что баланс всех атомов
Когда вы снова посмотрите на уравнение, вы увидите, что все атомы теперь сбалансированы.Убедитесь, что все детали добавлены
В начальном описании вам сказали, что цинк представляет собой металл, хлористоводородную кислоту и хлорид цинка в водных растворах, а водород - газ. Ханский академический видеофильм о балансирующих уравнениях. Напишите сбалансированные уравнения для каждой из следующих реакций, включая государственные символы.
А1 + ЗО 2 → →2А1 2 О 3
А1 -1 атом А1 - 4
НОК = 4
4:1=4 4:4=1
4А1 + ЗО 2 → →2А1 2 О 3
. Первичная проверка усвоения знаний(8-10 мин .).
В левой части схемы два атома кислорода, а в правой - один. Число атомов нужно выровнять с помощью коэффициентов.
Раствор нитрата свинца взаимодействует с раствором йодида калия с образованием осадка йодида свинца, в то время как нитрат калия остается в растворе. При нагревании алюминиевый металл реагирует с твердым оксидом меди для получения медного металла и оксида алюминия.
Общий эксперимент 1: Связь между продуктом и реагентом
Поэтому мы добавляем 2 перед аммиаком. Теперь мы проверим количество атомов каждого элемента в реагенте и продукте. Изучить взаимосвязь между количеством продукта и количеством реагента. Запишите объем газа, собранного в измерительном цилиндре. . Возможность балансировать химические уравнения - это жизненный навык для химии. Здесь мы рассмотрим шаги, связанные с балансированием уравнений, а также обработанный пример.
1)2Mg+O 2 →2MgO
2) СаСО 3 + 2HCl→ СаСl 2 + Н 2 О + СО 2
Задание 2 Расставьте коэффициенты в уравнениях химических реакций (обратите внимание, что коэффициент изменяет число атомов только одного элемента ):
1. Fe 2 O 3 + А l → А l 2 О 3 + Fe; Mg + N 2 → Mg 3 N 2 ;
Шаги балансировки химического уравнения
Число атомов каждого типа атома должно быть одинаковым с каждой стороны уравнения после его уравновешивания. Чистый заряд должен быть одинаковым с каждой стороны уравнения, как только он будет сбалансирован. Если возможно, начните с элемента, найденного в одном соединении с каждой стороны уравнения. Измените коэффициенты так, чтобы число атомов элемента было одинаковым с каждой стороны уравнения. Чтобы сбалансировать уравнение, вы изменяете коэффициенты, а не индексы в формулах. Легче оставить элементы, найденные в чистом виде, для последнего. Проверьте свою работу, чтобы убедиться, что заряд по обеим сторонам уравнения также сбалансирован.
Пример балансировки химического уравнения
- Каков чистый заряд по каждой стороне уравнения?
- Когда вы уравновешиваете один элемент, делайте то же самое с другим элементом.
- Продолжайте, пока все элементы не будут сбалансированы.
2. Al + S → Al 2 S 3 ; A1 + С → Al 4 C 3 ;
3. Al + Cr 2 O 3 → Cr + Al 2 O 3 ; Ca + P → Ca 3 P 2 ;
Как сбалансировать химическое уравнение для реакции редокс
Как только вы поймете, как сбалансировать уравнение по массе, вы готовы научиться балансировать уравнение как по массе, так и по зарплате. Балансировка для заряда означает, что у вас есть тот же чистый заряд как на стороне реагента, так и на продукте уравнения.
Вот пример того, как сбалансировать реакцию между перманганатом калия и иодидом в водной серной кислоте с образованием иодида калия и сульфата марганца. Это типичная реакция кислоты.
- Сначала напишите несбалансированное химическое уравнение.
- В этом примере первая половина реакции имеет заряд 7 слева и 2 справа.
- Добавьте 5 электронов влево, чтобы сбалансировать заряд.
- Вторая половина реакции имеет 2 слева и 0 справа.
4. С + H 2 → CH 4 ; Ca + С → СаС 2 ;
5. Fe + O 2 → Fe 3 O 4 ; Si + Mg → Mg 2 Si;
В сбалансированном химическом уравнении общее число атомов каждого присутствующего элемента одинаково с обеих сторон уравнения. Стехиометрические коэффициенты - это коэффициенты, необходимые для уравновешивания химического уравнения. Они важны, потому что они относятся к количеству используемых реагентов и к образовавшимся продуктам. Коэффициенты связаны с константами равновесия, потому что они используются для их вычисления. По этой причине важно понять, как сбалансировать уравнение перед использованием уравнения для вычисления констант равновесия.
6/.Na + S → Na 2 S; CaO + С → CaC 2 + CO;
7. Ca + N 2 → C a 3 N 2 ; Si + Cl 2 → SiCl 4 ;
8. Ag + S → Ag 2 S; Н 2 + С l 2 → НС l;
Существует несколько важных правил балансировки уравнения. Уравнение должно включать только реагенты и продукты, которые участвуют в реакции. Если элемент присутствует только в одном соединении с каждой стороны уравнения, попробуйте сначала сбалансировать этот элемент. Когда один элемент существует как свободный элемент, сбалансируйте этот элемент последним.
- Уравнение можно уравновесить только путем корректировки коэффициентов.
- Никогда не изменяйте уравнение, чтобы сбалансировать его.
9. N 2 + O 2 → NO; СО 2 + С → СО ;
10. HI → Н 2 → + 1 2 ; Mg + НС l → MgCl 2 + Н 2 ;
Это происходит, когда прямые и обратные реакции происходят с одинаковой скоростью. Константа равновесия используется для определения количества каждого соединения, которое присутствует в равновесии. Рассмотрим химическую реакцию следующей формы. Для этого уравнения константа равновесия определяется как.
Деятельность продуктов находится в числителе, а реагенты - в знаменателе. Строчные буквы - это стехиометрические коэффициенты, которые уравновешивают уравнение. Важным аспектом этого уравнения является то, что чистые жидкости и твердые вещества не включены. Это связано с тем, что их деятельность определяется как одна, поэтому включение их в уравнение не оказывает никакого влияния. Это связано с тем, что чистые жидкости и твердые тела не влияют на физическое равновесие; независимо от того, сколько добавлено, система может растворяться столько, сколько позволяет растворимость.
11. FeS + НС 1 → FeCl 2 + H 2 S; Zn+ HCl → ZnCl 2 + H 2 ;
12. Br 2 + KI → KBr+ I 2 ; Si + HF (r) → SiF 4 + H 2 ;
Например, если к раствору добавляется больше сахара после достижения равновесия, дополнительный сахар не растворяется. Когда коэффициенты в сбалансированном уравнении умножаются на общий коэффициент, константа равновесия поднимается до степени соответствующего фактора. Когда коэффициенты в сбалансированном уравнении делятся на общий множитель, берется соответствующий корень константы равновесия. Когда индивидуальные уравнения объединяются, их равновесные константы умножаются для получения константы равновесия для общей реакции. Сбалансированное уравнение очень важно при использовании константы, поскольку коэффициенты становятся степенью концентрации продуктов и реагентов.
1./ HCl+Na 2 CO 3 → CO 2 +H 2 O+ NaCl; KClO 3 + S → → KCl+ SO 2 ;
14. Cl 2 + KBr → KCl + Br 2 ; SiO 2 + С → Si + CO;
Если уравнение не сбалансировано, то константа неверна. Для газофазных равновесий уравнение является функцией реакционных веществ и парциальных давлений продуктов. Константа равновесия выражается следующим образом. Это связано с их формальными определениями в отношении видов деятельности.
Их единицы отменяются при расчете, предотвращая проблемы с единицами в дальнейших расчетах. Примечание. Это дало бы неправильный ответ. Шарлотта Хаттон, Сара Рено, Кертис Кортемайер. . В некоторых случаях, однако, мы не можем знать относительные количества каждого вещества, которое реагирует. К счастью, мы всегда можем найти правильные коэффициенты уравнения. Процесс нахождения коэффициентов известен как уравновешивание уравнения.
15. SiO 2 + С → SiC + CO; Mg + SiO 2 → Mg 2 Si + MgO
16 . Mg 2 Si + HCl → MgCl 2 + SiH 4
1.Что такое уравнение химической реакции?
Заключительное слово учителя
Во время химической реакции атомы не создаются и не разрушаются. Те же самые атомы присутствуют до и после реакции; они просто перестроены. Это называется Законом о сохранении материи, и мы можем использовать этот закон, чтобы помочь нам найти правильные коэффициенты для уравновешивания уравнения.
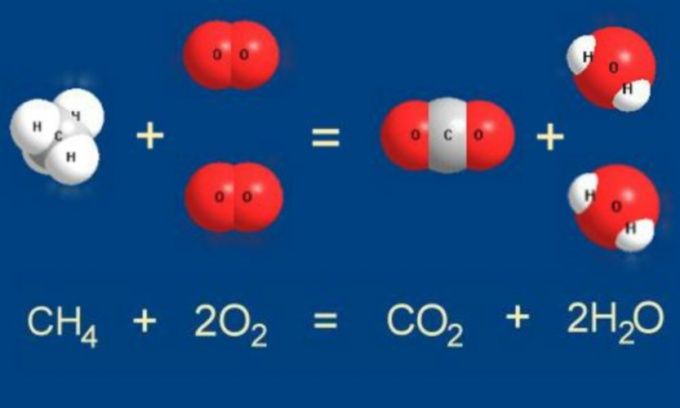
Например, предположим в приведенном выше уравнении, что мы не знаем, сколько молей газа аммиака будет производиться. Из-за Закона сохранения материи также должны быть 2 атома азота и 6 атомов водорода с правой стороны. Поскольку каждая молекула полученного газообразного аммиака содержит 1 атом азота и 3 атома водорода, необходимы 2 молекулы для получения 2 атомов азота и 6 атомов водорода. Реакция горения представляет собой реакцию между углеродной цепью с кислородом с образованием двуокиси углерода и воды, плюс тепло.
2.Что записывают в правой части уравнения? А в левой?
3.Что означает знак «+» в уравнении?
4. Зачем расставляют коэффициенты в уравнениях хим
ы в уравнениях химических реакций, если данная тема в школьном курсе по ряду каких-либо причин прошла мимо, а знать, между тем, это необходимо. Правильно расставлять коэффициенты можно, соблюдая определенные правила. Данный способ называется метод подстановки.
Инструкция
Прежде чем приступать к самому заданию, нужно усвоить, что цифра, которая ставится перед химическим элементом или всей формулой называется коэффициентом. А цифра, стоящая после (и чуть внизу) означает индекс. Кроме этого нужно знать, что:
Коэффициент относится ко всем химическим символам, стоящим после него в формуле
Коэффициент умножается на индекс (не складывается!)
Число атомов каждого элемента вступающих в реакцию веществ должно совпадать с числом атомов этих элементов, входящих в состав продуктов реакции.
Например, запись формулы 2H2SO4 означает 4 атома H (водорода), 2 атома S (серы) и 8 атомов O (кислорода).
1. Пример № 1. Рассмотрим горения этилена.
При сгорании органического вещества образуются оксид углерода (IV) (углекислый газ) и вода. Попробуем последовательно расставить коэффициенты.
C2H4 + O2 => CO2+ H2O
Начинаем анализировать. В реакцию в ступило 2 атома С (углерода), а получился только 1 атом, значит перед CO2 ставим 2. Теперь их количество одинаково.
C2H4 + O2 => 2CO2+ H2O
Теперь смотрим на H (водород). В реакцию вступило 4 атома водорода, а получилось в результате только 2 атома, следовательно, перед H2O (водой) ставим 2 – теперь получилось тоже 4
C2H4 + O2 => 2CO2+ 2H2O
Считаем все атомы О (кислорода), образовавшиеся в результате реакции (то есть, после знака равенства). 4 атома в 2CO2 и 2 атома в 2H2O – всего 6 атомов. А до реакции всего 2 атома, значит, перед молекулой кислорода O2 ставим 3, а значит, их стало тоже 6.
C2H4 + 3O2 => 2CO2+ 2H2O
Таким образом, получилось одинаковое количество атомов каждого элемента до и после знака равенства.
C2H4 + 3O2 => 2CO2+ 2H2O
2. Пример № 2. Рассмотрим реакцию взаимодействия алюминия с разбавленной серной кислотой.
Al + H2SO4 => Al2 (SO4) 3 + H2
Смотрим на атомы S, входящие в состав Al2 (SO4) 3 - их 3, а в H2SO4 (серной кислоте) только 1, следовательно, и перед серной кислотой тоже ставим 3.
Al + 3H2SO4 => Al2 (SO4) 3 + H2
Зато теперь получилось до реакции 6 атомов H (водорода), а после реакции только 2, значит, перед молекулой H2 (водорода) ставим тоже 3, чтобы в целом получилось 6.
Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
В последнюю очередь смотрим на алюминий. Так как в Al2 (SO4) 3 (сульфате алюминия) всего 2 атома алюминия, то и до реакции перед Al (алюминием) ставим 2.
2Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
Теперь количество всех атомов до и после реакции совпадает. Оказалось, что расставлять коэффициенты в химических уравнениях не так и сложно. Достаточно потренироваться и все получится.
Для многих школьников написать уравнения химических реакций и правильно расставить коэффициенты нелегкая задача. Причем, главную трудность у них почему-то вызывает именно вторая ее часть. Казалось бы, ничего сложного в том нет, однако порой ученики пасуют, впадая в полную растерянность. А ведь надо всего лишь запомнить несколько простых правил, и задача перестанет вызывать затруднения.
Инструкция
Коэффициент, то есть число, стоящее перед формулой молекулы химического вещества, относится ко всем символам, и умножается на каждый индекс каждого символа! Именно умножается, а не складывается! Это может показаться невероятным, но некоторые школьники складывают два числа вместо того, чтобы их перемножить.
Иными словами, если в левой части реакции записано:
2Na3PO4 + 3CaCl2 = … Это значит, что в реакцию вступило 6 атомов натрия, 2 атома фосфора, 8 атомов кислорода, 3 атома кальция и 6 атомов хлора.
Количество атомов каждого элемента исходных веществ (то есть находящихся в левой части уравнения) должно совпадать с количеством атомов каждого элемента продуктов реакции (соответственно, находящихся в его правой части).
Рассмотрим это правило, записав до конца уравнение реакции фосфата натрия с хлористым кальцием. Для большей наглядности, уберите из левой части уравнения коэффициенты . Na3PO4 + CaCl2 = Ca3(PO4)2 + NaCl
В ходе реакции образуется практически нерастворимая соль – фосфат кальция – и хлористый натрий. Как же расставить коэффициенты ? Сразу обратите внимание, что у фосфат-иона (РО4) в правой части уравнения индекс равен двум. Поэтому, чтобы уравнять количества атомов фосфора и кислорода в левой и правой части, перед формулой молекулы фосфата натрия надо поставить коэффициент 2. Получится: 2Na3PO4 + СaCl2 = Ca3(PO4)2 + NaCl
Вы видите, что количество атомов фосфора и кислорода уравнено, но пока еще различно количество атомов натрия, кальция и хлора. В левой части: натрия – 6 атомов, кальция – 1 атом, хлора – 2 атома. В правой части, соответственно: натрия – 1 атом, кальция – 3 атома, хлора – 1 атом.
Уравнивайте количество атомов натрия, приписав коэффициент 6 к молекуле хлористого натрия. Получается: 2Na3(PO4)2 + CaCl2 = Ca3(PO4)2 + 6NaCl
Осталось уравнять последние два элемента. Вы видите, что в левой части 1 атом кальция и 2 атома хлора, а в правой - 3 атома кальция и 6 атомов хлора. То есть, ровно в три раза больше! Подставляя коэффициент 3 к молекуле хлористого кальция, получите итоговое уравнение: 2Na3(PO4)2 + 3CaCl2 = Ca3(PO4)2 + 6NaCl