Что можно приготовить из кальмаров: быстро и вкусно
Существует несколько методов определения коэффициентов в уравнениях окислительно-восстановительных реакций. Мы используем метод электронного баланса, при котором составление полного уравнения ОВР проводится в следующей последовательности:
1. Составляют схему реакции, указав вещества, вступившие в реакцию, и вещества, получившиеся в результате реакции, например:
2. Определяют степень окисления атомов и пишут ее знак и величину над символами элементов, отмечая элементы, степень окисления которых изменилась:
3. Записывают электронные уравнения реакций окисления и восстановления, определяют число электронов, отданных восстановителем и принятых окислителем, и затем уравнивают их, умножая на соответствующие коэффициенты:
4. Полученные коэффициенты, отвечающие электронному балансу, переносят в основное уравнение:
5.Уравнивают число атомов и ионов, не меняющих степени окисления (в последовательности: металлы, неметаллы, водород):
6.Проверяют правильность подбора коэффициентов по числу атомов кислорода в левой и правой части уравнения реакции – они должны быть равны (в этом уравнении 24 = 18 + 2 + 4, 24 = 24).
Рассмотрим более сложный пример:
Определим степени окисления атомов в молекулах:
Составим электронные уравнения реакций окисления и восстановления и уравняем число отданных и принятых электронов:
Перенесем коэффициенты в основное уравнение:
Уравняем число атомов, не меняющих степень окисления:
Подсчитав число атомов кислорода в правой и левой части уравнения, убедимся, что коэффициенты подобраны правильно.
Важнейшие окислители и восстановители
Окислительно-восстановительные свойства элементов зависят от строения электронной оболочки атомов и определяются их положением в периодической системе Менделеева.
Металлы, имея на внешнем энергетическом уровне 1-3 электрона, легко их отдают и проявляют только восстановительные свойства. Неметаллы (элементы IV-VII групп) могут как отдавать, так и принимать электроны, поэтому они могут проявлять и восстановительные и окислительные свойства. В периодах с увеличением порядкового номера элемента восстановительные свойства простых веществ ослабевают, а окислительные усиливаются. В группах с повышением порядкового номера восстановительные свойства усиливаются, а окислительные ослабевают. Таким образом, из простых веществ лучшими восстановителями являются щелочные металлы, алюминий, водород, углерод; лучшими окислителями являются галогены и кислород .
Окислительно-восстановительные
свойства сложных веществ зависят от
степени окисления атомов, входящих в
их состав. Вещества,
содержащие атомы с низшей степенью
окисления, проявляют восстановительные
свойства
.
Важнейшими восстановителями являются
оксид углерода
 ,
сероводород
,
сероводород ,
сульфат железа(II)
,
сульфат железа(II)
 .Вещества,
в состав которых входят атомы с высшей
степенью окисления, проявляют окислительные
свойства
.
Важнейшими окислителями являются
перманганат калия
.Вещества,
в состав которых входят атомы с высшей
степенью окисления, проявляют окислительные
свойства
.
Важнейшими окислителями являются
перманганат калия
 ,
дихромат калия
,
дихромат калия ,
пероксид водорода
,
пероксид водорода ,
азотная кислота
,
азотная кислота ,
концентрированная серная кислота
,
концентрированная серная кислота .
.
Вещества,
содержащие атомы с промежуточной
степенью окисления, могут вести себя
как окислители или восстановители
в зависимости от свойств веществ, с
которыми они взаимодействуют, и условий
протекания реакции. Так в реакции с
 сернистая кислота проявляет
восстановительные свойства:
сернистая кислота проявляет
восстановительные свойства:
а при взаимодействии с сероводородом является окислителем:

Кроме того, для таких веществ возможны реакции самоокисления-самовосстановления, протекающие с одновременным увеличением и уменьшением степени окисления атомов одного и того же элемента, например:
Сила многих
окислителей и восстановителей зависит
от рН среды. Например,
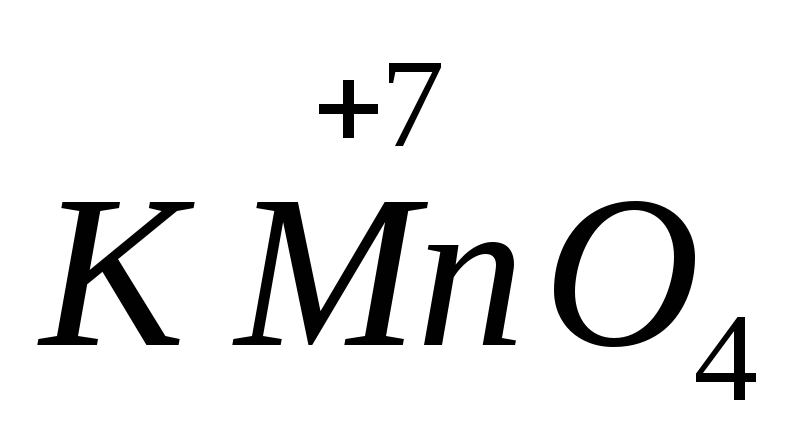 в щелочной среде восстанавливается до
в щелочной среде восстанавливается до ,
в нейтральной до
,
в нейтральной до ,
в присутствии серной кислоты - до
,
в присутствии серной кислоты - до .
.
Самое простое уравнение реакции:
Fe + S => FeS
Уравнение реакции нужно уметь не только записать, но и прочитать. Это уравнениев простейшем варианте читается так: молекула железа взаимодействует с молекулой серы, получается одна молекула сульфида железа.
Самое трудное в написании уравнения реакции- составить формулы продуктов реакции, т.е. образующихся веществ. Здесь правило только одно: формулы молекул строятся строго по валентности составляющих их элементов.
Кроме того, при составлении уравнений реакций надо помнить о законе сохранения массы веществ: все атомы молекул исходных веществ должны войти в состав молекул продуктов реакции. Ни один атом не должен исчезнуть или неожиданно появиться. Поэтому иногда, записав все формулы в уравнении реакции, приходится выравнивать число атомов в каждой части уравнения- расставлять коэффициенты. Вот пример:
С + O 2 => CO 2Здесь у каждого элемента одинаковое число атомов и в правой, и в левой части уравнения. Уравнение готово.
Cu + O 2 => CuO
А здесь атомов кислорода в левой части уравнения больше, чем в правой. Нужно, чтобы получилось столько молекул оксида меди
CuO , чтобы в них оказалось столько же атомов кислорода, т.е.2. Поэтому передформулой СuО ставим коэффициент2:Cu + O 2 => 2 CuO
Теперь неодинаково число атомов меди. В левой части уравнения перед знаком меди ставим коэффициент2:
2 Cu + O 2 => 2 CuO
Посчитайте, поровну ли атомов каждого элемента в левой и правой частях уравнения. Если да, то уравнение реакции составлено правильно.
Еще один пример: Al + O 2 = Al 2 O 3
И здесь атомов каждого элемента разное количество до реакции и после нее. Выравнивать начинаем с газа- с молекул кислорода:
1) Слева2 атома кислорода, а справа3. Ищем наименьшее общее кратное двух этих чисел. Это наименьшее число, которое делится и на2, и на3, т.е.6. Перед формулами кислорода и оксида алюминия Al 2 O 3 ставим такие коэффициенты, чтобы общее число атомов кислорода в этих молекулах было6:
Al + 3 O 2 = 2 Al 2 O 3
2) Считаем число атомов алюминия: слева1 атом, а справа в двух молекулах по2 атома, т.е.4. Перед знаком алюминия в левой части уравнения ставим коэффициент4:
4 Al + 3O 2 => 2 Al 2 O 3
3) Еще раз пересчитываем все атомы до реакции и после нее: по 4 атома алюминия и по 6 атомов кислорода.
Все в порядке, уравнение реакции составлено верно. А если реакция идет при нагревании, то над стрелкой дополнительно ставится знак t .
Уравнение химической реакции- это запись хода химической реакции с помощью химических формул и коэффициентов.
Для того чтобы выяснить, как уравнять химическое уравнение, для начала следует узнать предназначение данной науки.
Определение
Химия изучает вещества, их свойства, а также превращения. В случае если не наблюдается изменения окраски, выпадения осадка, выделения газообразного вещества, то не происходит никакого химического взаимодействия.
Например, при обработке напильником железного гвоздя металл просто превращается в порошок. В этом случае никакой химической реакции не происходит.
Прокаливание перманганата калия сопровождается образованием оксида марганца (4), выделением кислорода, то есть наблюдается взаимодействие. При этом возникает вполне закономерный вопрос о том, как правильно уравнивать химические уравнения. Разберем все нюансы, связанные с подобной процедурой.

Специфика химических превращений
Любые явления, которые сопровождаются изменением качественного и количественного состава веществ, относятся к химическим превращениям. В молекулярном виде процесс сгорания железа в атмосфере можно выразить с помощью знаков и символов.
Методика расстановки коэффициентов
Как уравнивать коэффициенты в химических уравнениях? В курсе химии средней школы разбирается метод электронного баланса. Рассмотрим процесс более подробно. Для начала в исходной реакции необходимо расставить степени окисления у каждого химического элемента.
Существуют определенные правила, по которым их можно определить у каждого элемента. В простых веществах степени окисления будут равны нулю. В бинарных соединениях у первого элемента она положительна, соответствует высшей валентности. У последнего данный параметр определяется путем вычитания номера группы из восьми и имеет знак «минус». В формулах, состоящих их трех элементов, есть свои нюансы вычисления степеней окисления.
Для первого и последнего элемента порядок аналогичен определению в бинарных соединениях, а для вычисления центрального элемента составляется уравнение. Сумма всех показателей должна быть равна нулю, исходя из этого, вычисляется показатель для среднего элемента формулы.
Продолжим разговор о том, как уравнивать химические уравнения методом электронного баланса. После того как степени окисления будут поставлены, можно определять те ионы либо вещества, которые в ходе химического взаимодействия изменили их значение.
Знаками «плюс» и «минус» необходимо указать количество электронов, которые были приняты (отданы) в процессе химического взаимодействия. Между полученными цифрами находят наименьшее общее кратное.
При делении его на принятые и отданные электроны получают коэффициенты. Как уравнять химическое уравнение? Полученные в балансе цифры нужно поставить перед соответствующими формулами. Обязательным условием является проверка количества каждого элемента в левой и правой части. Если коэффициенты расставлены правильно, их число должно быть одинаковым.

Закон сохранения массы веществ
Рассуждая над тем, как уравнять химическое уравнение, необходимо использовать именно этот закон. Учитывая, что масса тех веществ, которые вступили в химическую реакцию, равна массе образующихся продуктов, становится возможным постановка коэффициентов перед формулами. Например, как уравнять химическое уравнение, если вступают во взаимодействие простые вещества кальций и кислород, а после завершения процесса получается оксид?
Чтобы справиться с поставленной задачей, необходимо учитывать, что кислород является двухатомной молекулой с ковалентной неполярной связью, поэтому его формула записывается в следующем виде - О2. В правой части при составлении оксида кальция (СаО) учитывают валентности каждого элемента.
Сначала необходимо проверить количество кислорода в каждой части уравнения, так как оно отличается. По закону сохранения массы веществ перед формулой продукта нужно поставить коэффициент 2. Далее проводится проверка кальция. Для того чтобы он был уравнен, перед исходным веществом ставим коэффициент 2. В итоге получаем запись:
- 2Са+О2=2СаО.

Разбор реакции методом электронного баланса
Как уравнивать химические уравнения? Примеры ОВР помогут ответить на данный вопрос. Допустим, что необходимо методом электронного баланса расставить коэффициенты в предложенной схеме:
- CuO + Н2=Cu + Н2О.
Для начала у каждого из элементов в исходных веществах и продуктах взаимодействия расставим значения степеней окисления. Получим следующий вид уравнения:
- Cu(+2)О(-2)+Н2(0)=Cu(0)+Н2(+)О(-2).
Показатели изменились у меди и водорода. Именно на их основе будем составлять электронный баланс:
- Cu(+2)+2е=Cu(0) 1 восстановитель, окисление;
- Н2(0)-2е=2Н(+) 1 окислитель, восстановление.
Исходя из коэффициентов, полученных в электронном балансе, получаем следующую запись предложенного химического уравнения:
- CuO+Н2=Cu+Н2О.
Возьмем еще один пример, который предполагает постановку коэффициентов:
- Н2+О2=Н2О.
Для того чтобы уравнять на основе закона сохранения веществ данную схему, необходимо начать с кислорода. Учитывая, что вступала в реакцию двухатомная молекула, перед формулой продукта взаимодействия необходимо поставить коэффициент 2.
- 2Н2+О2=2Н2О.

Заключение
На основании электронного баланса можно расставлять коэффициенты в любых химических уравнениях. Выпускникам девятых и одиннадцатых классов образовательных учреждений, выбирающим экзамен по химии, в одном из заданий итоговых тестов предлагают подобные задания.
В уроке 13 «» из курса «Химия для чайников » рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
В результате реакции горения метана CH 4 в кислороде O 2 образуются диоксид углерода CO 2 и вода H 2 O. Эта реакция может быть описана химическим уравнением :
- CH 4 + O 2 → CO 2 + H 2 O (1)
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O 2 расходуется в расчете на 1 молекулу CH 4 и сколько молекул CO 2 и H2 O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.

Начнем с углерода. В левой части один атом С входит в состав молекулы CH 4 , а в правой части один атом С входит в состав CO 2 . Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
- 1CH 4 + O 2 → 1CO 2 + H 2 O (2)
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле H 4 = 4H) в составе молекулы CH 4 , а в правой – всего 2 атома H в составе молекулы H 2 O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H 2 O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
- 1CH 4 + O 2 → 1CO 2 + 2H 2 O (3)
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды H 2 O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2H 2 O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
- 1CH 4 + 2O 2 → 1CO 2 + 2H 2 O или СH 4 + 2O 2 → CO 2 + 2H 2 O (4)
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C 7 H 5 N 3 O 6 энергично соединяется с кислородом, образуя H 2 O, CO 2 и N 2 . Запишем уравнение реакции, которое будем уравнивать:
- C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (5)
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
- 2C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (6)
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
- 2C 7 H 5 N 3 O 6 + O 2 → 14CO 2 + 5H 2 O + 3N 2 (7)
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O 2 . Таким образом полное химическое уравнение будет иметь вид:
- 2C 7 H 5 N 3 O 6 + 10,5O 2 → 14CO 2 + 5H 2 O + 3N 2 (8)
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
- 4C 7 H 5 N 3 O 6 + 21O 2 → 28CO 2 + 10H 2 O + 6N 2 (9)
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
- C 7 H 5 N 3 O 6 + 5,25O 2 → 7CO 2 + 2,5H 2 O + 1,5N 2 (10)
Полное химическое уравнение (9) несет в себе много информации. Прежде всего оно указывает исходные вещества — реагенты , а также продукты реакции. Кроме того, оно показывает, что в ходе реакции индивидуально сохраняются все атомы каждого сорта. Если умножить обе части уравнения (9) на число Авогадро N A =6,022·10 23 , мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O 2 с образованием 28 молей CO 2 , 10 молей H 2 O и 6 молей N 2 .
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
- C 7 H 5 N 3 O 6 = 227,13 г/моль
- O2 = 31,999 г/моль
- CO2 = 44,010 г/моль
- H2 O = 18,015 г/моль
- N2 = 28,013 г/моль
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO 2 , 10·18,015 г = 180,15 г H 2 O и 6·28,013 г = 168,08 г N 2 . Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO2 | |
| 671,98 г CO2 | 180,15 г H2 O | |
| 168,08 г N2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2 :
- CaCO 3 + 2HCl → CaCl 2 + CO 2 + H 2 O (11)
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO 3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl 2 и диоксида углерода CO 2 . Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO 3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl 2 (110,99 г/моль), CO 2 (44,01 г/моль) и H 2 O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Интерпретация уравнения (11) на микроскопическом (молекулярном) уровне не столь очевидна, поскольку карбонат кальция представляет собой соль, а не молекулярное соединение, а потому нельзя понимать химическое уравнение (11) в том смысле, что 1 молекула карбоната кальция CaCO 3 реагирует с 2 молекулами HCl. Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H + и Cl — . Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
- CaCO 3 (тв.) + 2H + (водн.) → Ca 2+ (водн.) + CO 2 (г.) + H 2 O(ж.) (12)
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Уравнение (12) показывает, что твердый CaCO 3 реагирует с двумя гидратированными ионами H + , образуя при этом положительный ион Ca 2+ , CO 2 и H 2 O. Уравнение (12) как и другие полные химические уравнения не дает представления о молекулярном механизме реакции и менее удобно для подсчета количества веществ, однако, оно дает лучшее описание происходящего на микроскопическом уровне.
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений » вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.
1. Составим схему реакции:
Задачи урока. Обучающие. Познакомить учащихся с новой классификацией химических реакций по признаку изменения степеней окисления элементов – с окислительно-восстановительными реакциями (ОВР); научить учащихся расставлять коэффициенты методом электронного баланса.
Развивающие. Продолжить развитие логического мышления, умений анализировать и сравнивать, формирование интереса к предмету.
Воспитательные. Формировать научное мировоззрение учащихся; совершенствовать трудовые навыки.
Методы и методические приемы. Рассказ, беседа, демонстрация средств наглядности, самостоятельная работа учащихся.
Оборудование и реактивы. Репродукция с изображением Колосса Родосского, алгоритм расстановки коэффициентов по методу электронного баланса, таблица типичных окислителей и восстановителей, кроссворд; Fе (гвоздь), растворы NаОН, СuSО4.
ХОД УРОКА
Вводная часть
(мотивация и целеполагание)
Учитель. В III в. до н.э. на острове Родос был построен памятник в виде огромной статуи Гелиоса (у греков – бог Солнца). Грандиозный замысел и совершенство исполнения Колосса Родосского – одного из чудес света – поражали всех, кто его видел.
Мы не знаем точно, как выглядела статуя, но известно, что она была сделана из бронзы и достигала в высоту около 33 м. Статуя была создана скульптором Харетом, на ее строительство ушло 12 лет.
Бронзовая оболочка крепилась к железному каркасу. Полую статую начали строить снизу и, по мере того как она росла, заполняли камнями, чтобы сделать ее устойчивее. Примерно через 50 лет после завершения строительства Колосс рухнул. Во время землетрясения он переломился на уровне колен.
Ученые считают, что истинной причиной недолговечности этого чуда стала коррозия металла. А в основе процесса коррозии лежат окислительно-восстановительные реакции.
Сегодня на уроке вы познакомитесь с окислительно-восстановительными реакциями; узнаете о понятиях «восстановитель» и «окислитель», о процессах восстановления и окисления; научитесь расставлять коэффициенты в уравнениях окислительно-восстановительных реакций. Запишите в своих рабочих тетрадях число, тему урока.
Изучение нового материала
Учитель проделывает два демонстрационных опыта: взаимодействие сульфата меди(II) со щелочью и взаимодействие этой же соли с железом.
Учитель. Запишите молекулярные уравнения проделанных реакций. В каждом уравнении расставьте степени окисления элементов в формулах исходных веществ и продуктов реакции.
Ученик записывает на доске уравнения реакций и расставляет степени окисления:
Учитель. Изменились ли степени окисления элементов в этих реакциях?
Ученик. В первом уравнении степени окисления элементов не изменились, а во втором изменились – у меди и железа .
Учитель. Вторая реакция относится к окислительно-восстановительным. Попробуйте дать определение окислительно-восстановительных реакций.
Ученик. Реакции, в результате которых изменяются степени окисления элементов, входящих в состав реагирующих веществ и продуктов реакции, называют окислительно-восстановительными реакциями.
Учащиеся записывают в тетради под диктовку учителя определение окислительно-восстановительных реакций.
Учитель. Что же произошло в результате окислительно-восстановительной реакции? До реакции у железа была степень окисления 0, после реакции стала +2. Как видим, степень окисления повысилась, следовательно, железо отдает 2 электрона.
У меди до реакции степень окисления +2, после реакции – 0. Как видим, степень окисления понизилась. Следовательно, медь принимает 2 электрона.
Железо отдает электроны, оно является восстановителем, а процесс передачи электронов называется окислением.
Медь принимает электроны, она – окислитель, а процесс присоединения электронов называется восстановлением.
Запишем схемы этих процессов:
Итак, дайте определение понятий «восстановитель» и «окислитель».
Ученик. Атомы, молекулы или ионы, которые отдают электроны, называют восстановителями.
Атомы, молекулы или ионы, которые присоединяют электроны, называют окислителями.
Учитель. Какое определение можно дать процессам восстановления и окисления?
Ученик. Восстановлением называют процесс присоединения электронов атомом, молекулой или ионом.
Окислением называют процесс передачи электронов атомом, молекулой или ионом.
Учащиеся записывают под диктовку определения в тетрадь и выполняют рисунок.
Запомните!
Отдать электроны – окислиться.
Взять электроны – восстановиться.
Учитель. Окисление всегда сопровождается восстановлением, и наоборот, восстановление всегда связано с окислением. Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем.
Для подбора коэффициентов в уравнениях окислительно-восстановительных реакций используют два метода – электронного баланса и электронно-ионного баланса (метод полуреакций).
Мы рассмотрим только метод электронного баланса. Для этого используем алгоритм расстановки коэффициентов методом электронного баланса (оформлен на листе ватмана).
П р и м е р. Расставьте коэффициенты в данной схеме реакции методом электронного баланса, определите окислитель и восстановитель, укажите процессы окисления и восстановления:
Fe2O3 + CO Fe + CO2.
Воспользуемся алгоритмом расстановки коэффициентов методом электронного баланса.
3. Выпишем элементы, изменяющие степени окисления:
4. Составим электронные уравнения, определяя число отданных и принятых электронов:
5. Число отданных и принятых электронов должно быть одинаково, т.к. не заряжены ни исходные вещества, ни продукты реакции. Уравниваем число отданных и принятых электронов, подобрав наименьшее общее кратное (НОК) и дополнительные множители:
6. Полученные множители являются коэффициентами. Перенесем коэффициенты в схему реакции:
Fе2О3 + 3СО = 2Fе + 3СО2.
Вещества, являющиеся окислителями или восстановителями во многих реакциях, называются типичными.
Вывешивается таблица, выполненная на листе ватмана.
Учитель. Окислительно-восстановительные реакции очень распространены. С ними связаны не только процессы коррозии, но и брожение, гниение, фотосинтез, процессы обмена веществ, протекающие в живом организме. Их можно наблюдать при сгорании топлива.
Как уравнять химическое уравнение: правила и алгоритм
Окислительно-восстановительные процессы сопровождают круговороты веществ в природе.
Знаете ли вы, что в атмосфере ежедневно образуется примерно 2 млн т азотной кислоты, или
700 млн т в год, и в виде слабого раствора выпадают на землю с дождями (человек производит азотной кислоты лишь 30 млн т в год).
Что же происходит в атмосфере?
Воздух содержит 78% по объему азота, 21% кислорода и 1% других газов. Под действием грозовых разрядов, а на Земле ежесекундно вспыхивают в среднем 100 молний, происходит взаимодействие молекул азота с молекулами кислорода с образованием оксида азота(II):
Оксид азота(II) легко окисляется атмосферным кислородом в оксид азота(IV):
Образовавшийся оксид азота(IV) взаимодействует с атмосферной влагой в присутствии кислорода, превращаясь в азотную кислоту:
NO2 + Н2О + O2 HNO3.
Все эти реакции – окислительно-восстановительные.
Задание . Расставьте в приведенных схемах реакций коэффициенты методом электронного баланса, укажите окислитель, восстановитель, процессы окисления и восстановления.
Решение
1. Определим степени окисления элементов:
2. Подчеркнем символы элементов, степени окисления которых изменяются:
3. Выпишем элементы, изменившие степени окисления:
4. Cоставим электронные уравнения (определим число отданных и принятых электронов):
5. Число отданных и принятых электронов одинаково.
6. Перенесем коэффициенты из электронных схем в схему реакции:
Далее учащимся предлагается самостоятельно расставить коэффициенты методом электронного баланса, определить окислитель, восстановитель, указать процессы окисления и восстановления в других процессах, происходящих в природе.
Два других уравнения реакций (с коэффициентами) имеют вид:
Проверку правильности выполнения заданий проводят с помощью кодоскопа.
Заключительная часть
Учитель предлагает учащимся разгадать кроссворд по изученному материалу. Результат работы сдается на проверку.
Разгадав кроссворд , вы узнаете, что вещества КМnО4, К2Сr2O7, О3 – cильные … (по вертикали (2)).
По горизонтали:
1. Какой процесс отражает схема:
3. Реакция
N2 (г.) + 3Н2 (г.) 2NН3 (г.) + Q
является окислительно-восстановительной, обратимой, гомогенной, … .
4. … углерода(II) – типичный восстановитель.
5. Какой процесс отражает схема:
6. Для подбора коэффициентов в уравнениях окислительно-восстановительных реакций используют метод электронного … .
7. Согласно схеме алюминий отдал … электрона.
8. В реакции:
Н2 + Сl2 = 2НCl
водород Н2 – … .
9. Реакции какого типа всегда только окислительно-восстановительные?
10. Степень окисления у простых веществ – … .
11. В реакции:
восстановитель – … .
Задание на дом.
По учебнику О.С.Габриеляна «Химия-8» § 43, с. 178–179, упр. 1, 7 письменно. З а д а ч а (на дом). Конструкторы первых космических кораблей и подводных лодок столкнулись с проблемой: как поддержать постоянный состав воздуха на судне и космических станциях? Избавиться от избытка углекислого газа и пополнить запас кислорода? Решение было найдено.
Надпероксид калия KO2 в результате взаимодействия с углекислым газом образует кислород:
Как видите, это окислительно-восстановительная реакция. Кислород в этой реакции является и окислителем, и восстановителем.
В космической экспедиции на счету каждый грамм груза. Рассчитайте запас надпероксида калия, который необходимо взять в космический полет, если полет рассчитан на 10 дней и если экипаж состоит из двух человек. Известно, что человек за сутки выдыхает 1 кг углекислого газа.
(Ответ. 64,5 кг KO2.)
З а д а н и е (повышенный уровень сложности). Запишите уравнения окислительно-восстановительных реакций, которые могли привести к разрушению Колосса Родосского. Имейте в виду, что эта гигантская статуя стояла в портовом городе на острове в Эгейском море, у берегов современной Турции, где влажный средиземноморский воздух насыщен солями. Она была сделана из бронзы (сплав меди и олова) и смонтирована на железном каркасе.
Литература
Габриелян О.С
. Химия-8. М.: Дрофа, 2002;
Габриелян О.С., Воскобойникова Н.П., Яшукова А.В.
Настольная книга учителя. 8 класс. М.: Дрофа, 2002;
Кокс Р., Моррис Н
. Семь чудес света. Древний мир, средние века, наше время. М.: БММ АО, 1997;
Малая детская энциклопедия. Химия. М.: Русское энциклопедическое товарищество, 2001; Энциклопедия для детей «Аванта+». Химия. Т. 17. М.: Аванта+, 2001;
Хомченко Г.П., Севастьянова К.И.
Окислительно-восстановительные реакции. М.: Просвещение, 1989.
С.П.Лебешева,
учитель химии средней школы № 8
(г. Балтийск, Калининградская обл.)
Правила подбора коэффициентов:
— если число атомов элемента в одной части схемы реакции четное, а в другой нечетное, то перед формулой с нечетным числом атомов надо поставить коэффициент 2, а затем уравнивать число всех атомов.
— расстановку коэффициентов следует начинать с наиболее сложного по составу вещества и делать это в следующей последовательности:
сначала надо уравнять число атомов металлов, затем – кислотных остатков (атомов неметаллов), затем атомов водорода, и последним – атомов кислорода.
— если число атомов кислорода в левой и правой частях уравнения одинаково, то коэффициенты определены верно.
— после этого стрелку между частями уравнения можно заменить знаком равенства.
— коэффициенты в уравнении химической реакции не должны иметь общих делителей.
Пример. Составим уравнение химической реакции между гидроксидом железа (III) и серной кислотой с образованием сульфата железа (III).
1. Составим схему реакции:
Fe(OH)3 + H2SO4 → Fe2(SO4)3 + H2O
2. Подберем коэффициенты к формулам веществ. Мы знаем, что надо начать с наиболее сложного вещества и последовательно уравнять во всей схеме сначала атомы металлов, потом кислотных остатков, затем водорода и в конце – кислорода. В нашей схеме наиболее сложное вещество — Fe2(SO4)3. В нем два атома железа, а в составе Fe(OH)3 – один атом железа. Значит, перед формулой Fe(OH)3 надо поставить коэффициент 2:
2Fe(OH)3 + H2SO4 → Fe2(SO4)3 + H2O
Теперь уравниваем число кислотных остатков SO4. В составе соли Fe2(SO4)3 – три кислотных остатка SO4. Значит, в левой части перед формулой H2SO4 ставим коэффициент 3:
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + H2O.
Теперь уравниваем число атомов водорода. В левой части схемы в гидроксиде железа 2Fe(OH)3 – 6 атомов водорода (2
· 3), в серной кислоте 3H2SO4 – тоже 6 атомов водорода.
Как расставлять коэффициенты в химических уравнениях
Всего в левой части 12 атомов водорода. Значит, в правой части перед формулой воды H2O ставим коэффициент 6 – и теперь в правой части тоже 12 атомов водорода:
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O.
Осталось уравнять число атомов кислорода. Но делать это уже не надо, потому что в левой и правой частях схемы уже одинаковое число атомов кислорода – по 18 в каждой части. Это значит, что схема записана полностью, и мы можем стрелку заменить знаком равенства:
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O.
Образование
Как расставлять коэффициенты в химических уравнениях? Химические уравнения
Сегодня мы поговорим о том, как расставлять коэффициенты в химических уравнениях. Данный вопрос интересует не только старшеклассников общеобразовательных учреждений, но и ребят, которые только знакомятся с основными элементами сложной и интересной науки. Если на первом этапе понять, как составлять химические уравнения, в будущем проблем с решением задач не появится. Давайте разбираться с самого начала.
Что такое уравнение
Под ним принято подразумевать условную запись химической реакции, протекающей между выбранными реагентами. Для такого процесса используют индексы, коэффициенты, формулы.
Алгоритм составления
Как оформить химические уравнения? Примеры любых взаимодействий можно написать, суммируя исходные соединения. Знак равенства свидетельствует о том, что между реагирующими веществами протекает взаимодействие. Далее составляется формула продуктов по валентности (степени окисления).
Видео по теме
Как записать реакцию
Например, если нужно записать химические уравнения, подтверждающие свойства метана, выбираем следующие варианты:
- галогенирование (радикальное взаимодействие с элементом VIIA периодической таблицы Д. И. Менделеева);
- горение в кислороде воздуха.

Для первого случая в левой части пишем исходные вещества, в правой — полученные продукты. После проверки числа атомов каждого химического элемента получаем конечную запись происходящего процесса. При горении метана в кислороде воздуха происходит экзотермический процесс, в результате которого образуется углекислый газ и водяной пар.
Для того чтобы правильно поставить коэффициенты в химических уравнениях, используется закон сохранения массы веществ. Начинаем процесс уравнивания с определения количества атомов углерода. Далее проводим расчеты для водорода и только после этого проверяем количество кислорода.
ОВР
Сложные химические уравнения можно уравнять, вооружившись методом электронного баланса или полуреакций. Предлагаем последовательность действий, предназначенную для расстановки коэффициентов в реакциях следующих типов:

Сначала важно расставить у каждого элемента в соединении степени окисления. При их расстановке необходимо учитывать некоторые правила:
- У простого вещества она равна нулю.
- В бинарном соединении их сумма равна 0.
- В соединении из трех и более элементов у первого проявляется положительная величина, у крайнего иона - отрицательное значение степени окисления. Центральный элемент высчитывают математическим путем, учитывая, что в сумме должен быть 0.
Далее выбирают те атомы либо ионы, у которых изменился показатель степени окисления. Знаками «плюс» и «минус» показывают количество электронов (принятых, отданных). Далее между ними определяется наименьшее кратное. При делении НОК на эти цифры получают числа. Данный алгоритм и будет ответом на вопрос о том, как расставлять коэффициенты в химических уравнениях.
Первый пример
Допустим, дано задание: «Расставьте коэффициенты в реакции, дополните пропуски, определите окислитель и восстановитель». Такие примеры предлагаются выпускникам школы, которые выбрали химию в качестве ЕГЭ.
KMnO4 + H2SO4 + KBr = MnSO4 + Br2 +…+…

Попробуем понять, как расставлять коэффициенты в химических уравнениях, предлагаемых будущим инженерам и медикам. После расстановки степеней окисления у элементов в исходных веществах и имеющихся продуктах получаем, что в качестве окислителя выступает ион марганца, а восстановительные свойства демонстрирует бромид-ион.
Делаем вывод о том, что пропущенные вещества не участвуют в окислительно-восстановительном процессе. Одним из недостающих продуктов является вода, а вторым станет сульфат калия. После составления электронного баланса завершающим этапом станет постановка коэффициентов в уравнении.
Второй пример
Приведем еще один пример, чтобы понять, как расставлять коэффициенты в химических уравнениях окислительно-восстановительного вида.
Допустим, дана следующая схема:
P + HNO3 = NO2 +…+…
Фосфор, который по условию является простым веществом, проявляет восстановительные свойства, повышая степень окисления до +5. Поэтому одним из пропущенных веществ будет фосфорная кислота H3PO4. ОВР предполагает наличие восстановителя, которым будет выступать азот. Он переходит в оксид азота (4), образуя NO2

Для того чтобы поставить в этой реакции коэффициенты, составим электронный баланс.
P0 отдает 5e = P+5
N+5 принимает e = N+4
Учитывая, что перед азотной кислотой и оксидом азота (4) должен стоять коэффициент 5, получаем готовую реакцию:
P + 5HNO3 =5NO2 + H2O + H3PO4
Стереохимические коэффициенты в химии позволяют решать разнообразные расчетные задачи.
Третий пример
Учитывая, что расстановка коэффициентов вызывает у многих старшеклассников затруднения, необходимо отрабатывать последовательность действий на конкретных примерах. Предлагаем еще один пример задания, выполнение которого предполагает владение методикой расстановки коэффициентов в окислительно-восстановительной реакции.
H2S + HMnO4 = S + MnO2+…

Особенность предложенного задания в том, что необходимо дополнить пропущенный продукт реакции и только после этого можно переходить к постановке коэффициентов.
После расстановки степеней окисления у каждого элемента в соединениях можно сделать вывод, что окислительные свойства проявляет марганец, понижающий валентность. Восстановительную способность в предложенной реакции демонстрирует сера, восстанавливаясь до простого вещества. После составления электронного баланса нам останется только расставить коэффициенты в предлагаемую схему процесса. И дело сделано.
Четвертый пример
Химическое уравнение называют полным процессом в том случае, когда в нем в полном объеме соблюдается закон сохранения массы веществ. Как проверить эту закономерность? Количество атомов одного вида, которые вступили в реакцию, должно соответствовать их числу в продуктах взаимодействия. Только в этом случае можно будет вести речь о полноценности записанного химического взаимодействия, возможности его применения для проведения вычислений, решения расчетных задач разного уровня сложности. Приведем вариант задания, предполагающего расстановку в реакции недостающих стереохимических коэффициентов:
Si + …+ HF = H2SiF6 + NO +…

Сложность задания в том, что пропущены и исходные вещества, и продукты взаимодействия. После постановки всех элементов степеней окисления видим, что восстановительные свойства проявляет в предлагаемом задании атом кремния. Среди продуктов реакции присутствует азот (II), одним из исходных соединений является азотная кислота. Логическим путем определяем, что недостающим продуктом реакции является вода. Завершающим этапом будет расстановка полученных стереохимических коэффициентов в реакцию.
3Si + 4HNO3 + 18HF = 3H2SiF6 + 4NO + 8 H2O
Пример задачи на уравнение
Нужно определить объем 10 % раствора хлороводорода, плотность которого составляет 1,05 г/мл, необходимый для полной нейтрализации гидроксида кальция, образующегося в процессе гидролиза его карбида. Известно, что газ, выделяющийся в ходе гидролиза, занимает объем 8,96 л (н. у.) Для того чтобы справиться с поставленным заданием, необходимо сначала составить уравнение процесса гидролиза карбида кальция:
CaC2 + 2H2O = Ca (OH)2 + C2H2
Гидроксид кальция вступает во взаимодействие с хлороводородом, происходит полная нейтрализация:
Ca (OH)2 + 2HCl = CaCl2 + 2H2O

Вычисляем массу кислоты, которая потребуется для данного процесса.
Коэффициенты и индексы в химических уравнениях
Определяем объем раствора хлороводорода. Все расчеты по задаче проводятся с учетом стереохимических коэффициентов, что подтверждает их важность.
В заключение
Анализ результатов единого государственного экзамена по химии свидетельствует о том, что задания, связанные с постановкой стереохимических коэффициентов в уравнениях, составление электронного баланса, определение окислителя и восстановителя вызывают серьезные затруднения у современных выпускников общеобразовательных школ. К сожалению, степень самостоятельности современных выпускников практически минимальна, поэтому отработку теоретической базы, предложенной педагогом, старшеклассники не проводят.
Среди типичных ошибок, которые допускают школьники, расставляя коэффициенты в реакциях разного типа, много математических погрешностей. Например, не все умеют находить наименьшее общее кратное, правильно делить и умножать числа. Причина подобного явления в уменьшении количества часов, выделяемых в образовательных школах на изучение данной темы. При базовой программе по химии у педагогов нет возможности отрабатывать со своими школьниками вопросы, касающиеся составления электронного баланса в окислительно-восстановительном процессе.
Образование
Что такое квадрат? Как найти вершины, сечение, плоскость, уравнение, объем, площадь основания и угол квадрата?
Ответов на вопрос о том, что такое квадрат, может быть множество. Все зависит от того, кому вы этот вопрос адресовали. Музыкант скажет, что квадрат — это 4, 8, 16, 32 такта или джазовая импровизация. Ребенок — что это…
Автомобили
Антифриз как часто менять в автомобиле?
Во время работы двигателя автомобиля температура газов внутри его цилиндров достигает 2000 градусов. Из-за этого происходит сильный нагрев деталей силового агрегата. Для того чтобы отвести излишнее тепло от двигателя,…
Автомобили
Как работает термостат в автомобиле? Принцип действия
Ни один современный автомобиль не обходится без системы охлаждения. Именно она берет на себя все тепло, исходящее от двигателя при переработке горючей смеси. Поршни двигаются, смесь горит, соответственно, нужна хороша…
Автомобили
Как заправить кондиционер в машине своими руками? Как часто заправлять кондиционер в машине? Где можно заправить кондиционер в машине?
Автокондиционер — сегодня это не просто роскошь, а необходимое устройство транспортного средства, которое отвечает за благоприятный микроклимат в салоне. Практически все современные модели авто оснащены, если не клима…
Автомобили
Как почистить кондиционер в автомобиле своими руками?
Владельцы автомобилей должны постоянно заботиться о состоянии основных частей и механизмов своего транспортного средства. Ведь содержание их в чистоте и исправном состоянии позволяет получить оптимальный уровень безоп…
Автомобили
Масло трансмиссионное 80W90: характеристики, выбор, отзывы. Какое масло заливать в механическую коробку передач?
Масло трансмиссионное 80W90, характеристики которого мы сегодня рассмотрим, можно отнести к средним между классами вязкости 85W90 и 75W90. Узнаем подробнее, какими качественными характеристиками оно отличается от друг…
Автомобили
Какое масло заливать в гидроусилитель руля? Советы по замене масла в ГУР
Гидроусилитель рулевого управления, как и прочие узлы и агрегаты автомобиля, требует периодического обслуживания. Зачастую все профилактические мероприятия сводятся к замене рабочей жидкости. Нередко необходимо просто…
Автомобили
Как оплатить парковку в Москве? Правила платной парковки
Существуют правила платной парковки, созданные для того, чтобы изрядно облегчить жизнь московскому автомобилисту. Не секрет, что парковать транспортное средство в столице совсем непросто: обочины города переполнены ав…
Автомобили
Как сделать ароматизаторы в машину своими руками
Каждый автовладелец хочет, чтобы в салоне его железного коня всегда присутствовал приятный и любимый аромат. Кому-то нравится запах кофе, кому-то - цитрусовых, а кому-то - свежесть. Какие же ароматизаторы …
Автомобили
Как зарядить аккумулятор в домашних условиях?
Наверное, каждый автовладелец сталкивался с проблемой севшего аккумулятора. Эта неприятность может произойти с любым водителем, если не уделять источнику питания машины достаточного внимания.Мы поговорим о том,…
ВАРИАНТ 1
а) Na + O2 -> Na2O г) H2 + F2 -> HF
б) CaCO3-> CaO + CO2 д) H2O + K2O -> KOH
в) Zn + H2SO4 -> H2 + Zn SO4 е) Cu(OH)2 + HNO3 -> Cu(NO3)2 + H2O
Урок 13. Составление химических уравнений
Запишите определения:
а) реакция соединения б) экзотермическая реакция в) необратимая реакция.
а) углерод взаимодействует с кислородом и образуется оксид углерода (II);
б) оксид магния взаимодействует с азотной кислотой и образуется нитрат магния и вода;
в) гидроксид железа (III) разлагается на оксид железа (III) и воду;
г) метан СН4 горит в кислороде и образуется оксид углерода (IV) и вода;
д) оксид азота (V) при растворении в воде образует азотную кислоту.
4. Решите задачу по уравнению:
а) Какой объем фтороводорода образуется при взаимодействии водорода с фтором?
б) Какая масса оксида кальция образуется при разложении известняка, содержащего 80% CaCO3?
в) Какой объем и масса водорода выделится при взаимодействии с серной кислотой цинка, содержащего 35% примесей?
ВАРИАНТ 2
- Расставьте коэффициенты, определите тип химической реакции, под формулами запишите названия веществ:
а) P + O2 -> P2O5 г) H2 + N2 -> NH3
б) CaCO3 + HCl -> CaCl2 + H2O + CO2 д) H2O + Li2O -> LiOH
в) Mg + H2SO4 -> H2 + Mg SO4 е) Ca(OH)2 + HNO3 -> Ca(NO3)2 + H2O
2. Запишите определения:
а) реакция разложения б) эндотермическая реакция в) каталитическая реакция.
3. Запишите уравнения по описанию:
а) углерод взаимодействует с кислородом и образуется оксид углерода (IV);
б) оксид бария взаимодействует с азотной кислотой и образуется нитрат бария и вода;
в) гидроксид алюминия разлагается на оксид алюминия и воду;
г) аммиак NН3 горит в кислороде и образуется азот и вода;
д) оксид фосфора (V) при растворении в воде образует фосфорную кислоту.
4. Решите задачу по уравнению:
а) Какой объем аммиака образуется при взаимодействии водорода с азотом?
б) Какая масса хлорида кальция образуется при взаимодействии с соляной кислотой мрамора, содержащего 80% CaCO3?
в) Какой объем и масса водорода выделится при взаимодействии с серной кислотой магния, содержащего 30% примесей?
 Как оформить химические уравнения? Сначала важно расставить у каждого элемента в соединении степени окисления. Допустим, дано задание: «Расставьте коэффициенты в реакции, дополните пропуски, определите окислитель и восстановитель». Одним из недостающих продуктов является вода, а вторым станет сульфат калия. После составления электронного баланса завершающим этапом станет постановка коэффициентов в уравнении. Все расчеты по задаче проводятся с учетом стереохимических коэффициентов, что подтверждает их важность. Среди типичных ошибок, которые допускают школьники, расставляя коэффициенты в реакциях разного типа, много математических погрешностей.
Как оформить химические уравнения? Сначала важно расставить у каждого элемента в соединении степени окисления. Допустим, дано задание: «Расставьте коэффициенты в реакции, дополните пропуски, определите окислитель и восстановитель». Одним из недостающих продуктов является вода, а вторым станет сульфат калия. После составления электронного баланса завершающим этапом станет постановка коэффициентов в уравнении. Все расчеты по задаче проводятся с учетом стереохимических коэффициентов, что подтверждает их важность. Среди типичных ошибок, которые допускают школьники, расставляя коэффициенты в реакциях разного типа, много математических погрешностей.
Существуют определенные правила, по которым их можно определить у каждого элемента. В формулах, состоящих их трех элементов, есть свои нюансы вычисления степеней окисления. Продолжим разговор о том, как уравнивать химические уравнения методом электронного баланса. Обязательным условием является проверка количества каждого элемента в левой и правой части. Если коэффициенты расставлены правильно, их число должно быть одинаковым.
Алгебраический метод
Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
Химия изучает вещества, их свойства, а также превращения. В молекулярном виде процесс сгорания железа в атмосфере можно выразить с помощью знаков и символов. По закону сохранения массы веществ перед формулой продукта нужно поставить коэффициент 2. Далее проводится проверка кальция. Для начала у каждого из элементов в исходных веществах и продуктах взаимодействия расставим значения степеней окисления. Далее проводится проверка водорода.
Уравнивание химических реакций
Уравнивание химических реакций нужно для того, чтобы из простого химического уравнения получить полное. Начнем с углерода.
Закон сохранения массы исключает появление новых атомов и разрушение старых в ходе химической реакции. Обратите внимание на индекс каждого из атомов, именно он указывает их количество. Добавив индексы перед молекулами веществ в правой части уравнения, мы также изменили количество атомов кислорода. Теперь количество всех атомов углерода, водорода и кислорода является одинаковым в обеих частях уравнения.
Они говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на него. Начать необходимо с азота, так как его меньше, чем кислорода и водорода. Отлично, водород уравняли. На очереди у нас барий. Он уравнен, его трогать не нужно. До реакции присутствует два хлора, после нее - всего один. Что же нужно сделать? Теперь за счет коэффициента, который только что поставлен, после реакции получилось два натрия, и до реакции тоже два. Отлично, все остальное уравнено. Следующим действием мы должны расставить степени окисления всех элементов в каждом веществе для того, чтобы понять где произошло окисление, а где восстановление.

Пример разбора простых реакций
С правой стороны нет индексов, то есть одна частица кислорода, а с левой - 2 частицы. Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно. С правой части один умножаем на 2, чтобы получить и там 2 иона кислорода.
Прежде чем приступать к самому заданию, нужно усвоить, что цифра, которая ставится перед химическим элементом или всей формулой называется коэффициентом. Начинаем анализировать. Таким образом, получилось одинаковое количество атомов каждого элемента до и после знака равенства. Обязательно учитывайте, что коэффициент умножается на индекс, а не складывается.
Вам разрешается свободно использовать в своих целях любой документ при соблюдении следующих условий:
2) Символы химических элементов следует записывать строго в том виде, в котором они фигурируют в таблице Менделеева.
Карточка-информатор. "Алгоритм расстановки коэффициентов в уравнениях химических реакций."
3) Изредка возникают ситуации, когда формулы реагентов и продуктов записаны абсолютно верно, но коэффициенты все равно не расставляются. Наиболее вероятно возникновение такой проблемы с реакциями окисления органических веществ при которых рвется углеродный скелет.
Уравнение реакции нужно уметь не только записать, но и прочитать. Поэтому иногда, записав все формулы в уравнении реакции, приходится выравнивать число атомов в каждой части уравнения-расставлять коэффициенты. Посчитайте, поровну ли атомов каждого элемента в левой и правой частях уравнения.
Для многих школьников написать уравнения химических реакций и правильно расставить коэффициенты нелегкая задача. А ведь надо всего лишь запомнить несколько простых правил, и задача перестанет вызывать затруднения. Коэффициент, то есть число, стоящее перед формулой молекулы химического вещества, относится ко всем символам, и умножается на каждый индекс каждого символа!